Odborné služby klinického výzkumu
Plánujete realizaci projektu z oblasti klinického výzkumu a potřebuje pomoc či poradit?
Jsme tu pro vás. Díky naším zkušenostem, odborným znalostem a kapacitám, technologickému zázemí a vlastnímu softwaru pro sběr dat snadno zajistíme realizaci vašeho projektu. Od designu po závěrečnou zprávu.
Kromě realizace různých typů projektů nabízíme i konzultace a poradenství, které vám pomůže přizpůsobit váš projekt požadavkům regulačních úřadů a zefektivnit procesy. Konzultace poskytujeme zejména v oblastech: statistiky, regulačních záležitostí a projektového řízení…
„Zkušenosti a rady těch, kteří prošli podobnými výzvami, jsou hodnotou, kterou hledáte. Společně jsme chytřejší. Silnější.“
Prozkoumejte naše kategorie služeb a vyberte si tu, která nejlépe odpovídá vaším požadavkům a vašemu projektu. Naše pracovní portfolio zahrnuje především následující typy projektů, které realizujeme v souladu s platnými legislativními a regulačními předpisy.
Léčiva
Poskytujeme komplexní služby pro neintervenční studie (NIS) a pacientské registry. Nabízíme konzultace týkající se regulací léčiv, včetně Směrnice 2001/83/EC, Nařízení EU o klinických hodnoceních léčiv (2014/536) a Nařízení 2004/726.
Neintervenční observační studie léčiv (NIS)
Provádíme neintervenční studie léčiv pro komerční partnery i akademické instituce. Naším cílem je poskytnout reálný obraz o účinnosti, bezpečnosti a dopadech schválených léčiv v běžné praxi, v souladu s výzkumnou otázkou.
Pacientské registry
Efektivně řídíme a realizujeme pacientské registry pod záštitou odborných společností pomocí vlastního systému pro sběr dat, CLADE-IS , který splňuje nejvyšší standardy kvality a bezpečnosti. Díky nim mohou lékaři a další odborníci získat relevantní data o používaných léčebných metodách , zdravotním stavům a trendům sledované subpopulace pro podporu jejich rozhodování založené na důkazech a tím zlepšit svou klinickou praxi.
Klinické studie
Pro zadavatele klinických studií zajišťujeme, jako výzkumná organizace (CRO), řízení projektu od designu, po závěrečný report dle pravidel správné klinické praxe. Klinické studie realizujeme s využitím vlastního EDC systému pro sběr dat, CLADE-IS, s důrazem na kvalitu dat (statistický a on-site monitoring) a data statisticky zpracováváme a vyhodnocujeme. Cílem těchto studií je shromáždit kvalitní vědecká data a vyhodnotit účinnost, bezpečnost a vedlejší účinky léčby, léčiv nebo terapeutických zásahů na zdraví pacientů.
Zdravotnické prostředky
Předregistrační studie zdravotnických prostředků
Nabízíme komplexní podporu u předregistračních studií zdravotnických prostředků, za účelem získání CE značky dle nařízení EU MDR (2017/745, Medical devices regulation). Pomůžeme vám získat důkazy o bezpečnosti a účinnosti vašeho zdravotnického prostředku před jeho uvedením na trh. Připravíme kompletní dokumentaci pro podání studie na regulační orgány, včetně analýzy rizik klinické zkoušky (dle ISO 14 155) a zajistíme následné řízení zkoušky včetně sběru dat a jejich statistického vyhodnocení.
Sledování zdravotnických prostředků po uvedení na trh (PMCF)
Zajišťujeme komplexní řešení pro klinické sledování účinnosti a bezpečnosti zdravotnických prostředků po uvedení na trh, v souladu s nařízením EU MDR (2017/745, Medical devices regulation). Naším cílem je zajistit sledování dlouhodobé bezpečnosti a účinnosti vašich prostředků. Data získaná v rámci PMCF budou dostatečným podkladem pro doložení bezpečnosti a kvality vašeho zdravotnického prostředku po dobu celé jeho živostnosti.
In vitro diagnostiky
Studie funkční způsobilosti in vitro diagnostických prostředků
Nabízíme komplexní podporu pro studie funkční způsobilosti in vitro diagnostických prostředků dle nařízení EU IVDR, (2017/746, In vitro diagnostic medical devices regulation). Cílem těchto studií je potvrdit senzitivitu a specifitu diagnostických prostředků ve vztahu k určenému diagnostickému účelu před jeho uvedením na trh, a ověřit soulad s právními normami. Naším cílem je pomoci vám splnit všechny regulační požadavky pro vstup vašeho diagnostického prostředku na trh EU.
Sledování funkční způsobilosti in vitro diagnostických prostředků po uvedení na trh (PMPF)
Poskytujeme komplexní řešení pro sledování diagnostických zdravotnických prostředků po uvedení na trh v souladu s nařízením EU IVDR (2017/246, In vitro diagnostic medical devices regulation). Naším cílem je zajistit dlouhodobé sledování bezpečnosti a účinnosti vašeho in vitro diagnostického prostředku. Data získaná v rámci tohoto sledování PMPF budou dostatečným podkladem pro doložení bezpečnosti a kvality vašeho prostředku po dobu celé jeho živostnosti.
Pokud vás zajímají podrobnosti o poskytovaných službách v kontextu konkrétního typu projektu, kontaktujte nás a my se s vámi rádi spojíme.
Naše služby zahrnují
Regulatorní poradenství a konzultace
Potřebujete se zorientovat ve složitém regulačním prostředí klinických studií a zdravotnických prostředků? Pomůžeme vám dosáhnout vašich cílů v souladu s platnými předpisy. V kontextu vašeho projektu přeměníme vaši myšlenku a vize na konkrétní kroky a cíle.
„Řídit se normami a ovládnout kvalitu.“
Řízení projektů
Potřebujete efektivně naplánovat a řídit váš projekt? Sestavíme vašemu projektu harmonogram, přidělíme úkoly, zajistíme potřebné zdroje a postaráme se o komunikaci tak, aby všichni zúčastnění měli vždy potřebné informace – efektivně povedeme váš projekt od začátku do konce.
„Přeměnit hypotézu na výsledky.“
Studie proveditelnosti
Potřebujete zjistit, zda je váš projekt realizovatelný? Rádi vám pomůžeme s jeho komplexní analýzou. Posoudíme realizovatelnost vašeho projektu, zhodnotíme technické, organizační, metodologické, ekonomické a právní aspekty, identifikujeme rizika a vyhodnotíme dostupné zdroje a přínosy.
„Ověřit možnosti, otevřít příležitosti.“
Analýza klinických dat
Máte k dispozici klinická data a potřebujete je zanalyzovat? My vám je zanalyzujeme. Odpovíme vám na výzkumné otázky, identifikujeme trendy a poskytneme podklady pro informovaná rozhodnutí v rámci vašeho výzkumu či studie.
„Transformovat data na informace a znalosti.“
Management klinických dat
Zajišťujeme sběr, validaci a správu klinických dat, abychom zajistili jejich kvalitu – správnost, bezpečnost a přehlednost. S pomocí vlastního EDC systému.
„Organizovaná data – spolehlivé výsledky.“
Farmako/vigilance
Naše oddělení farmako/vigilance se postará o komplexní sledování, rekonciliaci, reporting a analýzu nežádoucích účinků vašich léků či zdravotnických prostředků, aby zajistilo jejich optimální bezpečnost a ochranu pacientů v souladu s regulačními požadavky.
„Sledovat a chránit.“
Psaní odborných textů (Medical Writing)
Píšeme srozumitelné odborné texty, které vyhovují vědeckým standardům a jsou přístupné široké veřejnosti. Potřebujete vytvořit poster, napsat závěrečnou zprávu, spolupracovat na odborném článku – nabízíme vám naši pomoc.
„Jasně myslet, jasně psát.“
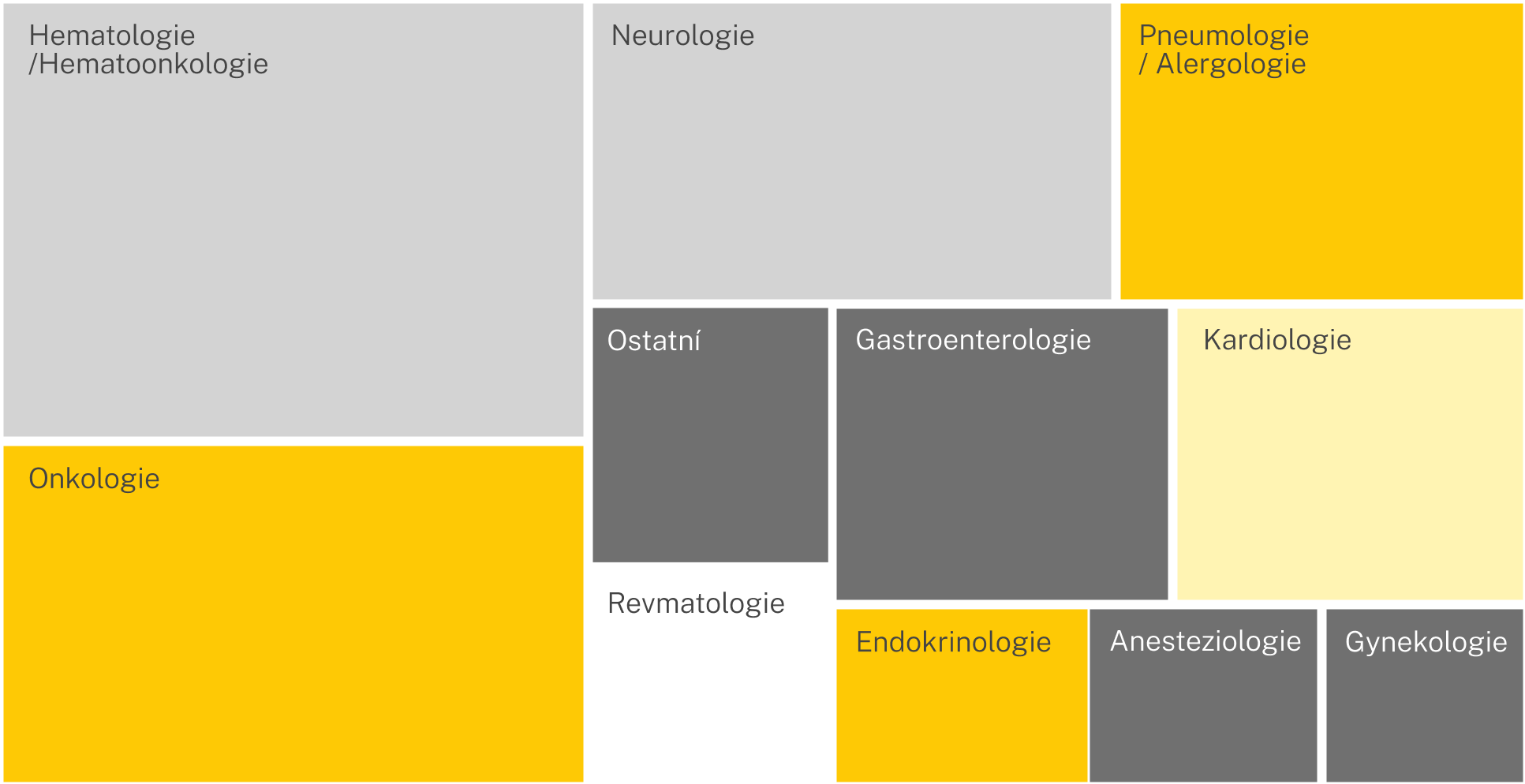
Klinické disciplíny
Máme zkušenosti s projekty z různých klinických disciplín a naše portfolio neustále rozšiřujeme. Naše zkušeností přehledně zobrazuje následující stromová mapa.
Průvodci službami klinického výzkumu
Klinické datové služby pro zajištění shody s MDR
Chcete mít jistotu, že váš zdravotnický prostředek splňuje všechny nároky Medical Device Regulation (MDR)? Neztrácejte čas hledáním správných postupů. My už jsme to udělali a umíme v tom chodit. Rádi vám pomůžeme dosáhnout kýženého cíle a udržet soulad s nejnovějšími předpisy. Ať už váš prostředek teprve vstupuje na trh, nebo provádíte jeho pravidelnou kontrolu, s námi budete mít MDR pod kontrolou – bez stresu, zbytečných komplikací a jak se říká „v souladu“. Více o naší nabídce se dočtete v průvodci „Clinical Data Services for MDR Compliance Ensuring Compliance and Improving Quality“.
Role reálných dat (RWE) v klinickém výzkumu
Pohybujete-li se v oblasti zdravotní péče, farmacie, výroby zdravotnických zařízení, správy klinických dat nebo projektového řízení klinických studií, pak by tento průvodce „Unlocking the power of real-world data in clinical research: a compelling value proposition“ mohl zcela změnit váš pohled na klinický výzkum. Zjistíte v něm, jaké nástroje, techniky a odborníky potřebujete pro úspěšné realizování projektů s reálnými důkazy a proč jsou reálná data tím, co chcete mít ve svém arzenálu.







